ENERGÍA NUCLEAR
ENERGÍA NUCLEAR |
Encontrar recursos energéticos casi inagotables, baratos y no contaminantes ha sido un afán del hombre casi desde el primer momento. Los combustibles tradicionales (carbón, petróleo, gas...) resultan caros, contaminan y son escasos.
El gran salto cuantitativo lo dio el descubrimiento, hacia 1938-1939, de que la fisión, esto es, la separación del núcleo de un átomo en otros elementos, liberaba gran cantidad de energía. Desgraciadamente esta energía, a pesar de su rendimiento, es también altamente peligrosa -recuérdese que uno de sus primeros usos fue el militar en Hiroshima y Nagasaki. Ténganse en cuenta también los desastres de Chernobil y las fugas más recientes en Japón y Corea del Sur, aparte de las que no se dan a conocer-.
La alternativa de futuro es la fusión nuclear. Pero antes de continuar conviene aclarar algunos conceptos fundamentales. La energía nuclear debe su nombre a que se basa en el poder de los núcleos de los átomos, por lo que debemos definir qué es un átomo, lo cual no resulta del todo fácil. Como aproximación baste decir que es la partícula más pequeña de un elemento químico que entra en combinación para formar dicho elemento.
 En física nuclear se estudian las llamadas partículas fundamentales, esto
es, las que forman parte de todos los átomos, y que según su número en éstos darán
los distintos tipos de átomos. Las partículas más conocidas y las necesarias a los
efectos de este trabajo son el electrón, el protón y el neutrón.
En física nuclear se estudian las llamadas partículas fundamentales, esto
es, las que forman parte de todos los átomos, y que según su número en éstos darán
los distintos tipos de átomos. Las partículas más conocidas y las necesarias a los
efectos de este trabajo son el electrón, el protón y el neutrón.
Un átomo está compuesto por un núcleo, formado por neutrones (no siempre) y protones
-llamados conjuntamente nucleones-. Estos con carga eléctrica positiva y aquellos neutra;
a su vez, el átomo consta de una envoltura electrónica a base de electrones, de carga
eléctrica negativa. En la naturaleza todos los átomos son eléctricamente neutros,
teniendo igual número de protones que de electrones.
Otros conceptos:
Número atómico Z: Es el número de protones que componen el núcleo del átomo. Así, el Hidrógeno (símbolo H), que es el átomo utilizado en la fusión nuclear, tiene un número Z=1, pues solamente dispone de un protón en su núcleo. De hecho, el hidrógeno es el elemento químico más sencillo y a la vez más abundante en la naturaleza.
Masa atómica A: Es la suma de protones y neutrones. También se llama número másico. Considerando N al número de neutrones de un átomo, tenemos que A=Z+N.
Peso atómico: Es el peso del átomo, tomando como unidad la duodécima parte del peso del átomo de Carbono (C). Así, el Hidrógeno pesa aproximadamente 1 y el Carbono 12.
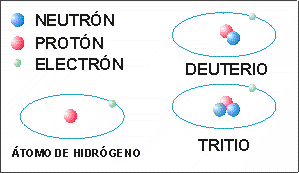
Isótopo: Un mismo tipo de átomo puede tener en su núcleo distinto número de neutrones. A cada variedad se le llama isótopo. Así, como se ve en el gráfico de abajo, el hidrógeno tiene tres isótopos diferentes: isótopo hidrógeno, isótopo deuterio e isótopo tritio. Estos dos últimos son los utilizados en la fusión nuclear.
Diferencia entre fisión y fusión.
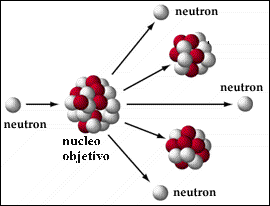
Por la fisión nuclear, un núcleo pesado como el Uranio 235, es dividido generalmente en dos núcleos más ligeros debido a la colisión de un neutrón (recordemos que un átomo se compone básicamente de electrones, protones y neutrones). Como el neutrón no tiene carga eléctrica atraviesa fácilmente el núcleo del Uranio. Al dividirse éste, libera más neutrones, que colisionan con otros átomos de Uranio creando la conocida reacción en cadena, de gran poder radioactivo y energético. Esta reacción se produce a un ritmo muy acelerado en las bombas nucleares, pero es controlado para usos pacíficos.
Por contra, la fusión consiste en la unión de dos núcleos ligeros (Litio y Deuterio) en uno más pesado (Helio), aunque la suma de su masa es menor que la masa de los núcleos reaccionantes, pues esa pérdida se ha convertido en energía, obteniéndose del orden de 4 veces más energía que en la fisión. Dicha energía se produce en virtud de la famosa Teoría de la Relatividad formulada por Albert Einstein, E=mc2 (Energía = masa por el cuadrado de la velocidad de la luz en el vacío), ya que aquella ni se crea ni se destruye, sino que se transforma. Hemos transformado masa en energía.
La radiactividad.
El descubrimiento de la radiactividad se debe al físico francés Henri Becquerel, al comprobar casualmente en 1896 cómo quedaba impresa una placa fotográfica en la que se habían colocado cristales de uranio y potasio, aun sin la intervención de la luz solar.
La radiactividad supone que las sustancias llamadas radiactivas emiten espontáneamente radiaciones capaces de atravesar la materia, impresionar placas fotográficas o producir ionización o fluorescencia.
La Radiación nuclear.
Los procesos nucleares emiten tres clases de radiaciones:
Partículas Alfa: Son núcleos de átomos de helio, compuestos por 2 neutrones y 2 protones. Tienen carga eléctrica positiva y se desvían poco al pasar a través de un campo electromagnético. Cuando un núcleo radiactivo emite una partícula alfa, su número atómico Z disminuye en 2 unidades, y su número másico (masa) en 4 unidades.
El nuevo núcleo corresponde a otro elemento químico, por ejemplo, cuando un núcleo de Uranio 238 (Z=92) emite una partícula alfa, el núcleo residual es Torio 234 (Z=90).
Partículas Beta: Son electrones de alta velocidad, que se desvían fácilmente ante un campo electromagnético. Cuando un núcleo emite una partícula beta su número atómico aumenta en 1 unidad, pero el número másico aumenta 2 unidades. Así, cuando Th 234 (Z=90) emite una partícula beta, resulta Th 235 (Z=92).
Rayos Gamma: Son fotones de gran energía. No se trata de partículas, sino de ondas electromagnéticas, como los rayos X o la luz, pero su energía es mucho mayor que ésta al tener una longitud de onda mucho menor.
Poder de penetración de la radiación.
Las partículas y rayos definidos tienen diferente poder de penetración en la materia. Así, y tomando como referencia una plancha de aluminio, tenemos:
- Partículas Alfa: 0,0005 cm. de espesor. Son absorbidos por una hoja de papel, que no logran atravesar.
- Partículas Beta: 0,050 cm. de espesor.
- Rayos Gamma: 8,000 cm. de espesor. Son los más peligrosos en toda reacción nuclear.
Actividad de una muestra radiactiva
Es el número de desintegraciones por segundo que en ella se producen, y es proporcional al número de átomos radiactivos que contenga. Esto nos lleva a la Ley de decrecimiento exponencial de la actividad de una muestra radiactiva, o dicho de otro modo, el tiempo que cada elemento radiactivo tarda en perder la mitad de su radiactividad (semivida).
Por ello, cuando se dice, por ejemplo, que el torio 238 tiene una semivida de 24,1 días, nos están diciendo que tarda ese tiempo en perder la mitad de su radiactividad.
ELEMENTO |
SEMIVIDA |
TIPO DE DESINTEGRACIÓN |
Uranio 238 |
4,51x109 años |
Alfa |
Uranio 234 |
2,48x105 años |
Alfa |
Torio 234 |
24,1 días |
Beta y Gamma |
Radio 226 |
1620 años |
Alfa y Gamma |
Radón 222 |
3,82 días |
Alfa |
Polonio 218 |
3,05 minutos |
Alfa |
Polonio 214 |
1,64x10-4 segundos |
Alfa |
De masa a energía.
Hemos dicho que la energía ni se crea ni se destruye, sino que sólo se transforma. El gran "secreto" de la energía atómica es que se obtiene energía de la variación de la masa de los átomos. Esta obtención de energía se basa en la referida fórmula de Einstein E = mc2.
Sustituyendo c por su valor tenemos: E = (2,99776 x 1010)2 = 8,9866 x 1020 unidades de energía por cada gramo de masa, lo que equivale a 25 millones de kilovatios/hora (25 Megawatios/hora) de energía por cada gramo de masa transformada. Sin embargo, no toda la masa se transforma en energía, por lo que siempre habrá cierta pérdida de ésta.
El Mega-electron-Volt
En las reacciones nucleares se expresa la energía en términos de eV (electrón Volt), unidad que corresponde a la energía susceptible de adquirir un electrón (carga del electrón = 1,602 x 10-19 columbios) bajo el campo electrostático de la unidad de medida MKS. Para expresar la energía en unidades de masa atómica (u.m.a)) se aplica la relación:
| 1 u.m.a = 9,315 x 108 eV = 931,5 MeV |